Moderna pede autorização para vacina contra Covid em crianças de seis meses
A Moderna, Inc., uma empresa de biotecnologia pioneira RNA (mRNA) – tecnologia de RNA mensageiro -, anunciou hoje que enviou uma solicitação de autorização de uso de emergência nos EUA para sua vacina Covid-19 (mRNA-1273) em crianças de 6 meses a menos de 2 anos e, 2 anos a menos de 6 anos de idade para a agencia sanitária do país — FDA, Food and Drug Administration, e que pedidos semelhantes estão em andamento com as autoridades regulatórias internacionais onde já possui registro*. As solicitações são baseadas em uma série primária de duas doses de 25 μg de mRNA-1273.
“Estamos orgulhosos de compartilhar que enviamos para autorização para a nossa vacina contra Covid-19 para crianças pequenas”, disse Stéphane Bancel, presidente corporativo da Moderna. “Acreditamos que a mRNA-1273 será capaz de proteger com segurança essas crianças contra o SARS-CoV-2, e isso é muito importante em nossa luta contínua contra a Covid-19, e será especialmente bem aceita pelos pais e cuidadores”.
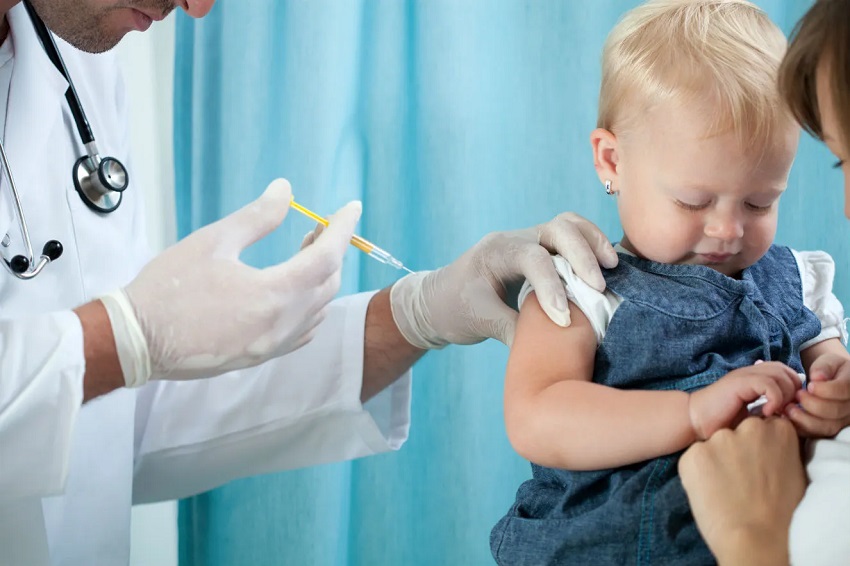
Resultados positivos da Fase 2/3 do estudo KidCOVE, anunciados em 23 de março de 2022, mostraram uma resposta robusta de anticorpos neutralizantes na faixa etária de 6 meses a menos de 6 anos após uma série primária de duas doses de mRNA-1273, juntamente com um perfil de segurança favorável. Os títulos de anticorpos nos subgrupos pré-especificados de 6 meses a 23 meses e 2 anos a menos de 6 anos atenderam aos critérios estatísticos para similaridade com os adultos no estudo de Cove, que satisfez o objetivo principal do estudo. Os resultados anunciados anteriormente incluíram uma análise de eficácia preliminar de suporte em casos coletados principalmente durante a onda da Omicron, incluindo testes domésticos para a Covid-19. Quando a análise é limitada apenas a casos confirmados positivos para SARS-CoV-2 pelo laboratório central, a eficácia da vacina RT-PCR permaneceu significativa em 51% (IC 95%: 21-69) para 6 meses a 2 anos e 37% (95% IC: 13-54) para 2 a 6 anos. Essas estimativas de eficácia são semelhantes às estimativas de eficácia da vacina em adultos contra Omicron após duas doses de mRNA-1273.
Na América Latina, o grupo Adium fechou um acordo com a Moderna para a distribuição e comercialização da SPIKEVAX, a vacina desenvolvida pela farmacêutica norte-americana contra o SARS-CoV-2. No Brasil, a operação será conduzida pela Zodiac Produtos Farmacêuticos, subsidiária do grupo Adium no país.
No âmbito do acordo, a Zodiac irá colaborar com Moderna na gestão dos contratos de fornecimento da vacina, bem como nos processos de registros nas agências reguladoras, apoio às atividades de Farmacovigilância, Educação Médica Continuada, Assuntos Governamentais para garantir acesso e disponibilidade da SPIKEVAX no Brasil.
No início do mês de abril, a Agência Nacional de Vigilância Sanitária (Anvisa) realizou uma reunião técnica com a Zodiac e a Moderna para tratar da regularização da vacina, que já conta com registro definitivo nos Estados Unidos, com autorização emergencial da Organização Mundial da Saúde, além de ter sido autorizada para uso em outros 84 países.
Atualmente, a Moderna está estudando doses de reforço para as duas cortes pediátricas mais antigas, e a empresa está projetando o estudo para avaliar o potencial para aqueles de 6 meses a menos de 6 anos. Além disso, está avaliando doses de reforço de mRNA-1273 e a vacina bivalente para dose de reforço, mRNA-1273.214, que inclui um mRNA específico para Omicron e mRNA-1273.
O estudo infantil está sendo realizado em colaboração com o Instituto Nacional de Alergia e Doenças Infecciosas (NIAID), parte dos Institutos Nacionais de Saúde (NIH) e da Autoridade de Pesquisa e Desenvolvimento Avançada Biomédica (Barda), parte do Gabinete do Secretário Assistente de Preparação e Resposta no Departamento de Saúde e Serviços Humanos dos EUA.